标准规范下载简介
在线阅读
中华人民共和国国家标准
医药工业洁净厂房设计规范
Code for design of pharmaceutical industry clean room
GB 50457-2008
主编部门:中国医药工程设计协会
批准部门:中华人民共和国住房和城乡建设部
施行日期:2009年6月1日
中华人民共和国住房和城乡建设部公告
第159号
关于发布国家标准
《医药工业洁净厂房设计规范》的公告
本规范由我部标准定额研究所组织中国计划出版杜出版发行。
中华人民共和国住房和城乡建设部
二〇〇八年十一月十二日
前 言
本规范是根据建设部“关于印发《2005年工程建设标准规范制订、修订计划(第二批)》的通知”(建标函[2005]124号)的要求,由中国石化集团上海工程有限公司会同中国医药集团武汉医药设计院和中国医药集团重庆医药设计院编制而成的。
本规范在编制过程中,结合近年来国内外GMP《药品生产质量管理规范》和洁净技术的发展以及工程建设的实践,广泛征求了有关单位的意见,最后经审查定稿。
本规范中以黑体字标志的条文为强制性条文,必须严格执行。
本规范由住房和城乡建设部负责管理和对强制性条文的解释,由中国石化集团上海工程有限公司负责具体技术内容的解释。在本规范执行过程中,希望各单位结合工程实践,认真总结经验,如有需要修改和补充之处,请将意见和建议寄交中国石化集团上海工程有限公司(地址:上海市浦东新区张杨路769号,邮编200120),以便今后修订时参考。
本规范主编单位、参编单位和主要起草人:
主编单位:中国石化集团上海工程有限公司
参编单位:中国医药集团武汉医药设计院
中国医药集团重庆医药设计院
主要起草人:缪德骅 王福国 汪征飏 吴天和 刘琳 陈宇奇 李安康 唐晓方 顾继红 俞友财 杨丽敏 陈芩晔 杨军 杨一心 韩立新 黄金富 刘元 吴霞
下载地址:
百度网盘: 新浪网盘:http://vdisk.weibo.com/s/EP2fcH0JO8jq
道客巴巴:http://www.doc88.com/p-9052609264943.html
1 总则
1.0.1 为在医药工业洁净厂房设计中贯彻执行国家有关方针政策和《药品生产质量管理规范》,做到技术先进、经济适用、安全可靠、确保质量,满足节约能源和环境保护的要求,制定本规范。
1.0.2 本规范适用于新建、扩建和改建的医药工业洁净厂房的设计。
1.0.3 医药工业洁净厂房的设计,应为施工安装、系统设施验证、维护管理、检修测试和安全运行创造必要的条件。
1.0.4 医药工业洁净厂房的设计,除应执行本规范外,尚应符合现行的国家有关标准的规定。
2 术 语
2.0.1 医药洁净室(区) pharmaceutical clean room(zone)
空气悬浮粒子和微生物浓度,以及温度、湿度、压力等参数受控的房间或限定空间。
2.0.2 人员净化用室 room for cleaning human body
人员在进入洁净区之前按一定程序进行净化的房间。
2.0.3 物料净化用室 room for cleaning material
物料在进入洁净区之前按一定程序进行净化的房间。
2.0.4 悬浮粒子 airborne particles
用于空气洁净度分级的空气中悬浮粒子尺寸范围在0.5~5μm的固体和液体粒子。
2.0.5 微生物 microorganisms
能够复制或传递基因物质的细菌或非细菌的微小生物实体。
2.0.6 含尘浓度 particle concentration
单位体积空气中悬浮粒子的颗数。
2.0.7 含菌浓度 microorganisms concentration
单位体积空气中微生物的数量。
2.0.8 空气洁净度 air cleanliness
以单位体积中空气某粒径粒子和微生物的数量来区分的洁净程度。
2.0.9 气流流型 air pattern
室内空气的流动形态和分布状态。
2.0.10 单向流 unidirectional airflow
沿单一方向呈平行流线并且横断面上风速一致的气流。
2.0.11 非单向流 non-unidirectional airflow
凡不符合单向流定义的气流。
2.0.12 混合流 mixed airflow
单向流和非单向流组合的气流。
2.0.13 气闸室 air lock
在洁净室(区)出入口,为了阻隔室外或邻室气流和压差控制而设置的房间。
2.0.14 传递柜 pass box
在洁净室隔墙上设置的传递物料和工器具的开口。两侧装有不能同时开启的柜门。
2.0.15 洁净工作服 clean working garment
为把工作人员产生的粒子和微生物限制在最低程度,所使用的发尘、发菌量少的洁净服装。
2.0.16 空态 as-built
设施已经建成,所有动力接通并运行,但无生产设备、材料及人员。
2.0.17 静态 at- rest
设施已经建成,生产设备已经安装,并按业主及供应商同意的状态运行,但无生产人员。
2.0.18 动态 operational
设施以规定的状态运行,有规定的人员在场,并在商定的状态下进行工作。
2.0.19 高效空气过滤器 high efficiency particulate air filter
在额定风量下,对粒径大于等于0.3μm粒子的捕集效率在99.97%以上及气流阻力在254Pa以下的空气过滤器。
2.0.20 工艺用水 process water
药品生产工艺中使用的水,包括饮用水、纯化水和注射用水。
2.0.21 纯化水 purity water
蒸馏法、离子交换法、反渗透或其他适宜的方法制得的,不含任何附加剂,供药用的水。
2.0.22 注射用水 water for injection
纯化水经蒸馏制得的水。
2.0.23 专用消防口 fire-firing access
消防人员为灭火而进入建筑物的专用入口。
2.0.24 自净时间 cleanliness recovery characteristic
洁净室被污染后,净化空调系统从开始运行至恢复到稳定的规定室内洁净度等级的时间。
2.0.25 无菌洁净室 sterile clean room
用于无菌作业的洁净室。
2.0.26 浮游菌 airborne viable particles
医药洁净室(区)悬浮在空气中的菌落。
2.0.27 沉降菌 sedimental viable particles
医药洁净室(区)沉降在物体表面的菌落。
2.0.28 无菌 sterile
不存在活的微生物。
2.0.29 灭菌 sterilize
使非无菌体达到无菌状态。
2.0.30 无菌药品 sterile product
法定药品标准中列有无菌检查的制剂。
2.0.31 非无菌药品 non-sterile product
法定药品标准中未列无菌检查的制剂。
2.0.32 验证 validation
证明任何程序、生产过程、设备、物料、活动或系统确实能达到预期效果的有文件证明的一系列活动。
2.0.33 在位清洗 cleaning in place
系统或设备在原安装位置不作任何移动条件下的清洗。
2.0.34 在位灭菌 sterilization in place
系统或设备在原安装位置不作任何移动条件下的灭菌。
.
3 生产区域的环境参数
3.1 一般规定
3.1.1 药品生产区域应符合国家现行《药品生产质量管理规范》关于环境参数的规定。
3.1.2 医药洁净室(区)应以微粒和微生物为主要控制对象,同时还应规定医药洁净室(区)环境的温度、湿度、压差、照度、噪声等参数。
3.1.3 环境空气中不应有异味以及有碍药品质量和人体健康的气体。
3.2 环境参数的设计要求
3.2.1 医药洁净室(区)的空气洁净度等级应按表3.2.1划分。
3.2.2 药品生产有关工序和环境区域的空气洁净度等级,应符合国家现行《药品生产质量管理规范》和附录A的要求。
3.2.3 医药洁净室(区)的温度和湿度,应符合下列规定:
1 生产工艺对温度和湿度无特殊要求时,空气洁净度100、10 000级的医药洁净室(区)温度应为20~24℃,相对湿度应为45%~60%;空气洁净度100 000级、300 000级的医药洁净室(区)温度应为18~26℃,相对湿度应为45%~65%。
2 生产工艺对温度和湿度有特殊要求时.应根据工艺要求确定。
3 人员净化及生活用室的温度,冬季应为16~20℃,夏季应为26~30℃。
3.2.4 不同空气洁净度等级的医药洁净室(区)之间以及医药洁净室(区)与非洁净室(区)之间的空气静压差不应小于5Pa,医药洁净室(区)与室外大气的静压差不应小于10Pa。
3.2.5 医药洁净室(区)应根据生产要求提供照度,并应符合下列规定:
1 主要工作室一般照明的照度值宜为300 lx。
2 辅助工作室、走廊、气闸室、人员净化和物料净化用室的照度值不宜低于150 lx。
3 对照度有特殊要求的生产部位可设置局部照明。
3.2.6 非单向流医药洁净室(区)的噪声级(空态)不应大于60dB(A),单向流和混合流医药洁净室(区)的噪声级(空态)不应大于65dB(A)。
.
4 厂址选择和总平面布置
4.1 厂址选择
4.1.1 厂区位置的选择,应经技术经济方案比较后确定,并应符合下列规定:
1 应设置在大气含尘浓度、含菌浓度和含有害气体浓度低,且自然环境好的区域。
2 宜远离铁路、码头、机场、交通要道,以及散发大量粉尘和有害气体的工厂、仓储、堆场,远离严重空气污染、水质污染、振动或噪声干扰的区域;如不能远离以上区域时,则应位于其最大频率风向上风侧。
4.1.2 医药工业洁净厂房新风口与市政交通主干道近基地侧道路红线之间的距离宜大于50m。
4.2 总平面布置
4.2.1 厂区的总平面布置应符合国家有关工业企业总体设计要求,并应满足环境保护的要求,同时应防止交叉污染。
4.2.2 厂区应按生产、行政、生活和辅助等功能布局。
4.2.3 医药工业洁净厂房应布置在厂区内环境整洁,且人流和货流不穿越或少穿越的地段,并应根据药品生产特点布局。
兼有原料药和制剂生产的药厂,原料药生产区应位于制剂生产区全年最大频率风向的下风侧。三废处理、锅炉房等有严重污染的区域,应位于厂区全年最大频率风向的下风侧。
4.2.4 青霉素类等高致敏性药品的生产厂房,应位于其他生产厂房全年最大频率风向的下风侧。
4.2.5 动物房的设置,应符合现行国家标准《实验动物环境及设施》GB/T 14925等的有关规定。
4.2.6 医药工业洁净厂房周围宜设置环形消防车道,如有困难,可沿厂房的两个长边设置消防车道。
4.2.7 厂区主要道路的设置,应符合人流与货流分流的要求。医药工业洁净厂房周围道路面层,应采用整体性好、发尘少的材料。
4.2.8 医药工业洁净厂房周围应绿化。厂区内宜减少露土面积,不应种植易散发花粉或对药品生产产生不良影响的植物。
.
5 工艺设计
5.1 工艺布局
5.1.1 工艺布局应符合生产工艺流程及空气洁净度等级的要求,并应根据工艺设备安装和维修、管线布置、气流流型以及净化空凋系统等各种技术措施的要求综合确定。
5.1.2 工艺布局应防止人流和物流之间的交叉污染,并应符合下列基本要求:
1 应分别设置人员和物料进出生产区域的出入口。对在生产过程中易造成污染的物料应设置专用出入口。
2 应分别设置人员和物料进入医药洁净室(区)前的净化用室和设施。
3 医药洁净室(区)内工艺设备和设施的设置,应符合生产工艺要求。生产和储存的区域不得用作非本区域内工作人员的通道。
4 输送人员和物料的电梯宜分开设置。电梯不应设置在医药洁净室内。需设置在医药洁净区的电梯,应采取确保医药洁净区空气洁净度等级要求的措施。
5 医药工业洁净厂房内物料传递路线宜短。
5.1.3 在符合工艺条件的前提下,医药工业洁净厂房内各种固定技术设施的布置,应根据净化空气凋节系统的要求综合协调。
5.1.4 医药洁净室(区)的布置,应符合下列要求:
1 在满足生产工艺和噪声级要求的前提下,空气洁净度等级高的医药洁净室(区)宜靠近空气调节机房布置,空气洁净度等级相同的工序和医药洁净室(区)的布置宜相对集中。
2 不同空气洁净度等级医药洁净室(区)之间的人员出入和物料传送,应有防止污染措施。
5.1.5 医药工业洁净厂房内,宜靠近生产区设置与生产规模相适应的原辅物料、半成品和成品存放区域。 存放区域内宜设置待验区和合格品区,也可采取控制物料待检和合格状态的措施。不合格品应设置专区存放。
5.1.6 青霉素类等高致敏性药品的生产厂房应独立设置。避孕药品、卡介苗、结核菌素的生产厂房必须与其他药品的生产厂房分开设置。
5.1.7 下列药品生产区之间,必须分开布置:
1 β-内酰胺结构类药品生产区与其他生产区。
2 中药材的前处理、提取和浓缩等生产区与其制剂生产区。
3 动物脏器、组织的洗涤或处理等生产区与其制剂生产区。
4 含不同核素的放射性药品的生产区。
5.1.8 下列生物制品的原料和成品,不得同时在同一生产区内加工和灌装:
1 生产用菌毒种与非生产用菌毒种。
2 生产用细胞与非生产用细胞。
3 强毒制品与非强毒制品。
4 死毒制品与活毒制品。
5 脱毒前制品与脱毒后制品。
6 活疫苗与灭活疫苗。
7 不同种类的人血液制品。
8 不同种类的预防制品。
5.1.9 生产辅助用室的布置和空气洁净度等级,应符合下列要求:
1 取样室宜设置在仓储区内,取样环境的空气洁净度等级应与使用被取样物料的医药洁净室(区)相同。无菌物料取样室应为无菌洁净室,取样环境的空气洁净度等级应与使用被取样物料的无菌操作环境相同,并应设置相应的物料和人员净化用室。
2 称量室宜设置布生产区内,称量室的空气洁净度等级应与使用被称量物料的医药洁净室(区)相同。
3 备料室宜靠近称量室布置,备料室的空气洁净度等级应与称量室相同。
4 设备、容器及工器具的清洗和清洗室的设置,应符合下列要求:
1)空气洁净度100级、10 000级医药洁净室(区)的设备、容器及工器具宜在本区域外清洗,其清洗室的空气洁净度等级不应低于100 000级。
2)如需在医药洁净区内清洗的设备、容器及工器具,其清洗室的空气洁净度等级应与该医药洁净区相同。
3)设备、容器及工器具洗涤后应干燥,并应在与使用该设备、容器及工器具的医药洁净室(区)相同的空气洁净度等级下存放。无菌洁净室(区)的设备、容器及工器具洗涤后应及时灭菌,灭菌后应在保持其无菌状态措施下存放。
5.1.10 医药洁净室(区)的清洁工具洗涤和存放室不宜设置在洁净区域内。如需设置在洁净区域内时,医药洁净室(区)的空气洁净度等级应与使用清洁工具的洁净室(区)相同。
无菌洁净区域内不应设置清洁工具洗涤和存放室。
5.1.11 洁净工作服洗涤、干燥和整理,应符合下列要求:
1 空气洁净度100 000级及以上的医药洁净室(区)的洁净工作服洗涤、干燥和整理室,其空气洁净度等级不应低于300 000级。
2 空气洁净度300 000级的医药洁净室(区)的洁净工作服可在清洁环境下洗涤和干燥。
3 不同空气洁净度等级的医药洁净室(区)内使用的工作服,应分别清洗和整理。
4 无菌工作服的洗涤和干燥设备宜专用。洗涤干燥后的无菌工作服应在空气洁净度100级单向流下整理,并应及时灭菌。
5.1.12 无菌洁净室的设置,应根据本规范第5.1.9、5.1.13条和附录A确定。
5.1.13 质量控制实验室的布置和空气洁净度等级,应符合下列规定:
1 检验、中药标本、留样观察以及其他各类实验室应与药品生产区分开设置。
2 各类实验室的设置,应符合下列要求:
1)阳性对照、无菌检查、微生物限度检查和抗生素微生物检定等实验室,以及放射性同位素检定室等应分开设置。
2)无菌检查室、微生物限度检查实验室应为无菌洁净室,其空气洁净度等级不应低于10 000级,并应设置相应的人员净化和物料净化设施。
3)抗生素微生物检定实验室和放射性同位素检定室的空气洁净度等级不宜低于100 000级。
3 有特殊要求的仪器应设置专门仪器室。
4 原料药中间产品质量检验对生产环境有影响时,其检验室不应设置在该生产区内。
5.1.14 下列情况的医药洁净室(区)应予以分隔:
1 生产的火灾危险性分类为甲、乙类与非甲、乙类生产区之间或有防火分隔要求时。
2 按药品生产工艺有分隔要求时。
3 生产联系少,且经常不同时使用的两个生产区域之间。
5.1.15 医药工业洁净厂房应设置防止昆虫和其他动物进入的设施。
5.2 人员净化
5.2.1 医药工业洁净厂房内人员净化用室和生活用室的设置,应符合下列要求:
1 人员净化用室应根据产品生产工艺和空气洁净度等级要求设置。不同空气洁净度等级的医药洁净室(区)的人员净化用室宜分别设置。空气洁净度等级相同的无菌洁净室(区)和非无菌洁净室(区),其人员净化用室应分别设置。
2 人员净化用室应设置换鞋、存外衣、盥洗、消毒、更换洁净工作服、气闸等设施。
3 厕所、淋浴室、休息室等生活用室可根据需要设置,但不得对医药洁净室(区)产生不良影响。
5.2.2 人员净化用室和生活用室的设计,应符合下列要求:
1 人员净化用室入口处,应设置净鞋设施。
2 存外衣和更换洁净工作服的设施应分别设置。
3 外衣存衣柜应按设计人数每人一柜设置。
4 人员净化用室的空气净化要求,应符合本规范第9.2.11条的规定。
5 盥洗室应设置洗手和消毒设施。
6 厕所和浴室不得设置在医药洁净区域内,宜设置在人员净化用室外。需设置在人员净化用室内的厕所应有前室。
7 医药洁净区域的入口处应设置气闸室;气闸室的出入门应采取防止同时被开启的措施。
8 青霉素等高致敏性药品、某些甾体药品、高活性药品及有毒害药品的人员净化用室,应采取防止有毒有害物质被人体带出人员净化用室的措施。
5.2.3 医药工业洁净厂房内人员净化用室和生活用室的面积,应根据不同空气洁净度等级和工作人员数量确定。
5.2.4 医药洁净室(区)的人员净化程序宜按图5.2.4布置。
5.3 物料净化
5.3.1 医药洁净室(区)的原辅物料、包装材料和其他物品出入口,应设置物料净化用室和设施。
5.3.2 进入无菌洁净室(区)的原辅物料、包装材料和其他物品,除应满足本规范第5.3.1条的规定外,尚应在出入口设置供物料、物品灭菌用的灭菌室和灭菌设施。
5.3.3 物料清洁室或灭菌室与医药洁净室(区)之间.应设置气闸室或传递柜。
5.3.4 传递柜密闭性应好,并应易于清洁。两边的传递门应有防止同时被开启的措施。传递柜的尺寸和结构,应满足传递物品的大小和重量所需要求。传送至无菌洁净室(区)的传递柜应设置相应的净化设施。
5.3.5 生产过程中产生的废弃物出口,宜单独设置专用传递设施,不宜与物料进口合用一个气闸室或传递柜。
5.4 工艺用水
5.4.1 饮用水的制备和使用,应符合下列要求:
1 饮用水的制备方式,应保证其水质符合现行国家标准《生活饮用水卫生标准》GB 5749的有关规定。
2 饮用水的储存和输送,应符合本规范第10.2.1和10.2.2条的规定。
5.4.2 纯化水的制备、储存和分配,应符合下列要求:
1 纯化水的制备方式,应保证其水质电阻率大于0.5MΩ·cm,并应符合现行《中华人民共和国药典》的纯化水标准的规定。
2 用于纯化水储罐和输送管道、管件等的材料,应无毒、耐腐蚀、易于消毒,并宜采用内壁抛光的优质不锈钢或其他不污染纯化水的材料。储罐的通气口应安装不脱落纤维的疏水性过滤器。
3 纯化水输送管道系统应采取循环方式。设计和安装时不应出现使水滞留和不易清洁的部位。循环的干管流速宜大于1.5m/s,不循环的支管长度不应大于管径的6倍。纯化水终端净化装置的设置应靠近使用点。
4 纯化水储罐和输送系统,应有清洗和消毒措施。
5.4.3 注射用水的制备、储存和使用,应符合下列要求:
1 注射用水的制备方式,应保证其水质符合现行《中华人民共和国药典》的注射用水标准的规定。
2 用于注射用水储罐和输送管道、管件等的材料,应无毒、耐腐蚀,并应采用内壁抛光的优质低碳不锈钢管或其他不污染注射用水的材料。储罐的通气口应安装不脱落纤维的疏水性除菌器。
3 注射用水的储存可采用65℃以上保温循环的方式,也可采用80℃以上或4℃以下保温的方式。循环时干管流速宜大于1.5m/s。
4 注射用水输送管道系统应采取循环方式。
5 注射用水输送管道系统设计和安装时,不应出现使水滞留和不易清洁的部位。使用点不循环支管长度不应大于管径的6倍。注射用水终端净化装置的设置应靠近使用点。
6 输送注射用水的不锈钢管道,应采用内壁无斑痕的对接氩弧焊焊接。需要拆洗的不锈钢管道宜采用卡箍式、法兰等优质低碳不锈钢卫生管件连接,法兰垫片材料宜采用聚四氟乙烯。不锈钢管道焊接后宜钝化。
7 注射用水储罐和输送系统,应设置在位清洗和在位灭菌设施。
5.4.4 医药洁净室(区)内工艺用水系统的验证,应符合附录C规定。
.
6 工艺管道
6.1 一般规定
6.1.1 医药洁净室(区)内应少敷设管道。工艺管道的干管,宜敷设在技术夹层或技术夹道中。需要拆洗和消毒的管道宜明敷。易燃、易爆、有毒物料管道应明敷,当需穿越技术夹层时,应采取安全密封措施。
6.1.2 管道在设计和安装时,不应出现使输送介质滞留和不易清洁的部位。
6.1.3 在满足工艺要求的前提下,工艺管道宜短。
6.1.4 工艺管道的干管系统应设置吹扫口、放净口和取样口。
6.1.5 输送纯化水的干管应符合本规范第5.4.2条的规定,输送注射用水的干管应符合本规范第5.4.3条的规定。
6.1.6 工艺管道不宜穿越与其无关的医药洁净室(区)。
6.1.7 输送有毒、易燃、有腐蚀性介质的工艺管道,应根据介质的理化性质控制物料的流速,并应符合本规范第6.4节的有关规定。
6.1.8 与药品直接接触的工业气体净化装置,应根据气源和生产工艺对气体纯度的要求选择。气体终端净化装置的设置,应靠近用气点。
6.1.9 可燃气体和氧气管道的末端或最高点应设置放散管。引至室外的放散管应高出屋面1m,并应采取防雨和防异物侵入措施。
6.2 管道材料、阀门和附件
6.2.1 管道、管件等材料和阀门应根据所输送物料的理化性质和使用工况选用。采用的材料和阀门应满足工艺要求,不应吸附和污染介质。
6.2.2 工艺物料的干管不宜采用软性管道,不得采用铸铁、陶瓷、玻璃等脆性材料。当采用塑性较差的材料时,应有加固和保护措施。
6.2.3 输送无菌介质和成品的管道材料宜采用内壁抛光的优质低碳不锈钢或其他不污染物料的材料;输送纯水的管道材料应符合本规范第5.4.2条的规定;输送注射用水的管道材料应符合本规范第5.4.3条的规定。
6.2.4 引入医药洁净室(区)的明敷管道,应采用不锈钢或其他不污染环境的材料。
6.2.5 工艺管道上的阀门、管件材质,应与连接的管道材质相适应。
6.2.6 医药洁净室(区)内采用的阀门、管件除应满足工艺要求外,尚应采用拆卸、清洗和检修方便的结构形式。
6.2.7 管道与设备宜采用金属管材连接。采用软管连接时,应采用金属软管。
6.3 管道的安装、保温
6.3.1 工艺管道的连接宜采用焊接。不锈钢管应采用内壁无斑痕的对接氩弧焊。
6.3.2 管道与阀门连接宜采用法兰、螺纹或其他密封性能优良的连接件。接触工艺物料的法兰和螺纹的密封圈应采用不易污染介质的材料。
6.3.3 穿越医药洁净室(区)墙、楼板、顶棚的管道应敷设套管,套管内的管段不应有焊缝、螺纹和法兰。管道与套管之间应有密封措施。
6.3.4 医药洁净室(区)内的管道,应排列整齐,宜减少阀门、管件和管道支架的设置。管道支架应采用不易锈蚀、表面不易脱落颗粒性物质的材料。
6.3.5 医药洁净室(区)内的管道,应根据管道的表面温度、发热或吸热量及环境的温度和湿度确定保温形式。冷保温管道的外壁温度不得低于环境的露点温度。
6.3.6 管道保温层表面应平整和光洁,不得有颗粒性物质脱落,并宜采用不锈钢或其他金属外壳保护。
6.3.7 医药洁净室(区)内的管道外壁,均应采取防锈措施。
6.3.8 医药洁净室(区)内的各类管道,均应设置指明内容物及流向的标志。
6.4 安全技术
6.4.1 存放及使用易燃、易爆、有毒介质设备的放散管应引至室外,并应设置相应的阻火装置、过滤装置和防雷保护设施。
6.4.2 输送易燃介质的管道,应设置导除静电的接地设施。
6.4.3 下列部位应设置易燃、易爆介质报警装置和事故排风装置,报警装置应与相应的事故排风装置相连锁:
1 甲、乙类火灾危险生产的介质入口室。
2 管廓、技术夹层或技术夹道内有易燃、易爆介质管道的易积聚处。
3 医药洁净室(区)内使用易燃、易爆介质处。
6.4.4 医药工业洁净厂房内不得使用压缩空气输送易燃、易爆介质。
6.4.5 各种气瓶应集中设置在医药洁净室(区)外。当日用气量不超过一瓶时,气瓶可设置在医药洁净室(区)内,但必须采取不积尘和易于清洁的措施。
.
7 设 备
7.1 一般规定
7.1.1 医药洁净室(区)内应采用防尘和防微生物污染的制药设备和设施。
7.1.2 用于制剂生产的配料、混合、灭菌等主要设备和用于原料药精制、干燥、包装的设备,其容量宜与批量相适应。
7.1.3 用于制剂包装的机械,应操作简单、不易产生差错。出现不合格、异物混入或性能故障时,应有调整或显示的功能。
7.1.4 制药设备和机械上的仪器仪表应计量准确,精确度应符合要求,调节控制应稳定。需控制计数的部位出现不合格或性能故障时,应有调整或显示功能。
7.1.5 制药设备保温层表面应平整和光洁,不得有颗粒性物质脱落。表面宜采用不锈钢或其他金属外壳保护。
7.1.6 当设备在不同空气洁净度等级的医药洁净室(区)之间安装时,应采用密封隔断装置。当确实无法密封时,应严格控制不同空气洁净度等级的医药洁净室(区)之间的压差。
7.1.7 空气洁净度10 000级的医药洁净室(区)使用的传输设备不得穿越较低级别区域。
7.1.8 医药洁净室(区)内的各种设备均应选用低噪声产品。对于辐射噪声值超过洁净室容许值的设备,应设置专用隔声设施。
7.1.9 医药洁净室(区)与周围工程楼内强烈振动的设备及其管道连接时,应采取主动隔振措施。有精密设备、仪器仪表的医药洁净室(区),应根据各类振源对其影响采取被动隔振措施。
7.2 设计和选用
7.2.1 制药设备应结构简单、表面光洁和易于清洁。装有物料的制药设备应密闭。 与物料直接接触的设备内壁,应光滑和平整,并应易于清洗、耐消毒和耐腐蚀。
7.2.2 与物料直接接触的制药设备内表面,应采用不与物料反应、不释放微粒、不吸附物料的材料。生产无菌药品的设备、容器、工器具等应采用优质低碳不锈钢。
7.2.3 制药设备的传动部件应密封,并应采取防止润滑油、冷却剂等泄漏的措施。
7.2.4 制药设备应经常清洗,需清洗和灭菌的零部件应易于拆装;不便移动的制药设备应设置在位清洗设施,需灭菌的制药设备应设置在位灭菌设施。
7.2.5 药液过滤不得使用吸附药物组分和释放异物的装置。
7.2.6 对生产中发尘量大的制药设备应设置捕尘装置,排风应设置气体过滤和防止空气倒灌的装置。
7.2.7 与药物直接接触的干燥用空气、压缩空气、惰性气体等均应设置净化装置。经净化处理后,气体所含微粒和微生物应符合使用环境空气洁净度等级的要求。干燥设备出风口应有防止空气倒灌的装置。
7.2.8 有爆炸危险的设备的设计和选用,应符合现行国家标准《爆炸和火灾危险环境电力装置设计规范》GB 50058等的有关规定。
7.2.9 医药洁净室(区)内设备的安装,不宜采用地脚螺栓。
7.2.10 制药设备应设置满足有关参数验证要求的测试点。
7.2.11 无菌洁净室(区)内的设备,除应符合本规范的规定外,尚应满足灭菌的需要。
7.2.12 特殊药品的生产设备,应符合下列规定:
1 青霉素类等高致敏性药品,β-内酰胺结构类药品,放射性类药品,卡介苗、结核菌素、芽孢杆菌类等生物制品,血液或动物脏器、组织类制品等的生产设备必须专用。
2 生产甾体激素类、抗肿瘤类药品制剂,当无法避免与其他药品交替使用同一设备时,应采取防护和清洁措施,并应进行设备清洁验证。
3 难以清洁的特殊药品的生产设备宜专用。
.
8 建 筑
8.1 一般规定
8.1.1 建筑平面和空间布局,应具有灵活性。医药洁净室(区)的主体结构宜采用大空间或大跨度柱网,不宜采用内墙承重体系。
8.1.2 医药工业洁净厂房围护结构的材料应满足保温、隔热、防火和防潮等要求。
8.1.3 医药工业洁净厂房主体结构的耐久性,应与室内装备和装修水平相适应,并应具有防火、控制温度变形和不均匀沉陷性能。厂房变形缝不宜穿越医药洁净室(区);当需穿越时应有保证洁净区气密性的措施。
8.1.4 医药洁净室(区)应设置技术夹层或技术夹道。穿越楼层的竖向管线需暗敷时,宜设置技术竖井。技术夹层、技术夹道和技术竖井的形式、尺寸和构造,应满足风道和管线的安装、检修和防火要求。
8.1.5 医药洁净室(区)内的通道应留有适当宽度,物流通道宜设置防撞构件。
8.1.6 医药洁净室(区)的围护结构,应具有隔声性能。
8.2 防火和疏散
8.2.1 医药工业洁净厂房的耐火等级不应低于二级。
8.2.2 医药工业洁净厂房内防火分区最大允许的建筑面积,应符合下列规定:
1 甲、乙类医药工业洁净厂房,单层厂房宜为3000㎡,多层厂房宜为2000㎡。
2 丙、丁类医药工业洁净厂房,应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。
8.2.3 医药洁净室(区)的顶棚和壁板(包括夹芯材料)应采用非燃烧体,且不得采用燃烧时产生有害物质的有机复合材料。顶棚的耐火极限不应低于0.4h,壁板的耐火极限不应低于0.5h,疏散走道的顶棚和壁板的耐火极限不应低于1.0h。
8.2.4 技术竖井井壁应采用非燃烧体,其耐火极限不应低于1.0h。井壁上检查门的耐火极限不应低于0.6h;竖井内各层或间隔一层楼板处,应采用与楼板耐火极限相同的非燃烧体作水平防火分隔;穿越水平防火分隔的管线周围空隙,应采用耐火材料紧密填堵。
8.2.5 医药工业洁净厂房每一生产层、每一防火分区或每一洁净区的安全出口数目不应少于两个,但符合下列要求的可设一个:
1 甲、乙类生产厂房或生产区建筑面积不超过100㎡,且同一时间内的生产人数不超过5人。
2 丙、丁、戊类生产厂房,应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。
8.2.6 安全出口应分散设置,从生产地点至安全出口不应经过曲折的人员净化路线,并应设置疏散标志,安全疏散距离应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。
8.2.7 医药洁净区与非洁净区、医药洁净区与室外相通的安全疏散门应向疏散方向开启,并应加设闭门器,门扇四周应密闭。
8.2.8 医药工业洁净厂房及医药洁净室(区)同层外墙应设置供消防人员通往厂房洁净室(区)的门窗,门窗的洞口间距大于80m时,应在该段外墙设置专用消防口。
专用消防口的宽度不应小于750mm,高度不应小于1800mm,并应设置明显标志。楼层的消防口应设置阳台,并应从二层开始向上层架设钢梯。
8.2.9 有爆炸危险的医药洁净室(区)应设置泄压设施,其泄压值应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。
8.3 室内装修
8.3.1 医药工业洁净厂房的建筑围护结构和室内装修,应采用气密性好且在温度和湿度变化的作用下变形小的材料。
8.3.2 医药洁净室(区)内装修应符合下列要求:
1 内表面应平整光滑、无裂缝、接口严密、无颗粒物脱落,并应耐清洗和耐消毒。
2 墙壁与地面交界处宜成弧形。踢脚不应突出墙面。
3 当采用砌体隔墙时,墙面应采用高级抹灰标准。
8.3.3 医药洁净室(区)的地面设计,应符合下列要求:
1 地面应满足生产工艺的要求。
2 地面应整体性好、平整、不开裂、耐磨、耐撞击和防潮,并应不易积聚静电且易于除尘清洗。
3 地面垫层宜配筋,潮湿地区垫层应做防潮构造。
8.3.4 医药工业洁净厂房技术夹层的墙面和顶棚应平整、光滑。需在技术夹层内更换高效空气过滤器时,其墙面和顶棚宜采用涂料饰面。
8.3.5 技术夹层采用轻质吊顶时,宜设置检修走道。
8.3.6 建筑风道和回风地沟的内表面装修,应与整个送、回风系统相适应,并应易于除尘。
8.3.7 医药洁净室(区)和人员净化用室设置外窗时,应采用气密性好的中空玻璃固定窗。
8.3.8 医药洁净室(区)内的门窗、墙壁、顶棚等的设计,应符合下列要求:
1 医药洁净室(区)内的门窗、墙壁、顶棚、地(楼)面的构造和施工缝隙,应采取密闭措施。
2 门框不宜设置门槛。
3 医药洁净区域的门、窗不宜采用木质材料。需采用时应经防腐处理,并应有严密的覆面层。
4 无菌洁净室(区)的门、窗不应采用木质材料。
8.3.9 医药洁净室(区)的门的大小应满足一般设备安装、修理和更换的要求。门宜朝空气洁净度等级较高的房间开启,并应加设闭门器。无窗洁净室的门上宜设置观察窗。
8.3.10 医药洁净室(区)的窗宜与内墙面齐平,不宜设置窗台。无菌洁净室的窗宜采用双层玻璃。
8.3.11 医药洁净室(区)内墙面与顶棚采用涂料面层时,应采用耐腐蚀、耐清洗、表面光滑和不易生霉的材料。
8.3.12 医药洁净室(区)内的色彩宜淡雅柔和。医药洁净室(区)内各表面材料的光反射系数,顶棚和墙面宜为0.6~0.8,地面宜为0.15~0.35。
8.3.13 医药洁净室(区)内装修材料的燃烧性能,应符合现行国家际准《建筑内部装修设计防火规范》GB 50222的有关规定。
.
9 空气净化
9.1 一般规定
9.1.1 药品生产环境的空气洁净度等级的确定,除应符合本规范第3.2.2条的规定外,尚应符合下列要求:
1 医药洁净室(区)内有多种工序时,应根据生产工艺要求,采用相应的空气洁净度等级。
2 在满足生产工艺要求的前提下,医药洁净室的气流流型宜采用工作区局部净化或全室空气净化,也可采用工作区局部净化和全室空气净化相结合的形式。
9.1.2 医药洁净室(区)内温度、湿度、压差、噪声等环境参数的控制,应符合本规范第3.2节的规定。
9.1.3 医药洁净室(区)内的新鲜空气量,应取下列最大值:
1 补偿室内排风量和保持室内正压所需新鲜空气量。
2 室内每人新鲜空气量不应小于40m³ /h。
9.1.4 医药洁净室(区)与周围的空间,应按工艺要求维持正压差或负压差。
9.1.5 医药洁净室(区)不应采用散热器采暖。
9.1.6 医药洁净室(区)内的空气监测和净化空调系统维护要求,应符合附录B的规定。
9.1.7 医药洁净室(区)内净化空调系统的验证,应符合附录C的规定。
9.2 净化空气调节系统
9.2.1 空气洁净度100级、10 000级及100 000级的空气净化处理,应采用粗效、中效、高效空气过滤器三级过滤。空气洁净度300 000级的空气净化处理,可采用亚高效空气过滤器。
9.2.2 空气过滤器的选用和布置方式,应符合下列要求:
1 中效空气过滤器宜集中设置在净化空气处理机组的正压段。
2 高效或亚高效空气过滤器宜设置在净化空气调节系统的末端。
3 在回风和排风系统中,高效、亚高效空气过滤器及作为预过滤的中效过滤器应设置在系统的负压段。
4 中效、高效空气过滤器应按小于或等于额定风量选用。
5 设置在同一洁净区内的高效、亚高效过滤器运行时的阻力和效率宜相近。
9.2.3 净化空气调节系统与一般空气调节系统应分开设置。
9.2.4 下列情况的净化空气调节系统宜分开设置:
1 运行班次或使用时间不同。
2 对温、湿度控制要求差别大。
9.2.5 下列情况的净化空气调节系统的空气不应循环使用:
1 生产过程散发粉尘的洁净室(区),其室内空气如经处理仍不能避免交叉污染时。
2 生产中使用有机溶媒,且因气体积聚可构成爆炸或火灾危险的工序。
3 病原体操作区。
4 放射性药品生产区。
5 生产过程中产生大量有害物质、异味或挥发性气体的生产工序。
9.2.6 生产过程中散发粉尘的医药洁净室(区)应设置除尘设施,除尘器应设置在净化空气调节系统的负压段。采用单机除尘时,除尘器应设置在靠近发尘点的机房内;如机房门向医药洁净室(区)方向开启的,机房内环境要求宜与医药洁净室(区)相同。间歇使用的除尘系统,应有防止医药洁净室(区)压差变化的措施。
9.2.7 有爆炸危险的除尘系统,应采用有泄爆和防静电装置的防爆除尘器。防爆除尘器应设置在排尘系统的负压段,并应设置在独立的机房内或室外。
9.2.8 医药洁净室(区)的排风系统,应符合下列规定:
1 应采取防止室外气体倒灌的措施。
2 排放含有易燃、易爆物质气体的局部排风系统,应采取防火、防爆措施。
3 对直接排放超过国家排放标准的气体,排放时应采取处理措施。
4 对含有水蒸气和凝结性物质的排风系统,应设置坡度及排放口。
5 生产青霉素等特殊药品的排风系统应符合本规范第9.6.4条的规定。
9.2.9 采用熏蒸消毒灭菌的医药洁净室(区),应设置消毒排风设施。
9.2.10 下列情况的排风系统,应单独设置:
1 不同净化空气调节系统。
2 散发粉尘或有害气体的区域。
3 排放介质毒性为现行国家标准《职业性接触毒物危害程度分级》GB 5044中规定的中度危害以上的区域。
4 排放介质混合后会加剧腐蚀、增加毒性、产生燃烧和爆炸危险性或发生交叉污染的区域。
5 排放易燃、易爆介质的区域。
9.2.11 人员净化用室中的更衣室、气闸室,应送入与洁净室(区)净化空调系统相同的洁净空气。人员净化用室的净化空气,应符合下列要求:
1 空气洁净度100级、10 000级医药洁净室(区)的更换洁净工作服室,换气次数宜为15次/h。
2 空气洁净度100 000级医药洁净室(区)的更换洁净工作服室,换气次数宜为10次/h。
3 空气洁净度300 000级医药洁净室(区)的更换洁净工作服室,换气次数宜为8次/h。
4 气闸室的空气洁净度等级应与相连的医药洁净室(区)空气洁净度等级相同。
5 人员净化用室各房间的空气应由里向外流动。
6 设置在人员净化室内的换鞋、存外衣、盥洗、厕所、淋浴室等生产辅助房间,应采取通风措施。
9.2.12 送风、回风和排风的启闭应连锁。正压洁净室(区)连锁程序为先启动送风机,再启动回风机和排风机;关闭时连锁程序应相反。
9.2.13 非连续运行的医药洁净室(区),可根据生产工艺要求设置值班送风。
9.2.14 放散大量有害气体或有爆炸气体的医药洁净室(区)应设置事故排风装置,事故排风系统应设置自动和手动控制开关,手动控制开关应分别设置在洁净室(区)内和洁净室(区)外便于操作的地点。
9.2.15 医药工业洁净厂房疏散走廊应设置排烟设施。医药工业洁净厂房防排烟设计应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。
9.2.16 净化空调系统噪声超过允许值时,应采取隔声、消声、隔振等措施,消声设施不得影响洁净室净化条件。
9.2.17 医药洁净室(区)的压差应符合本规范第3.2.4条的规定。净化空调系统应采取维持系统风量和医药洁净室(区)内各房间压差的措施。
9.2.18 下列医药洁净室(区)应设置指示压差的装置:
1 不同空气洁净度等级的洁净室(区)之间。
2 无菌洁净室与非无菌洁净室之间。
3 按本规范第9.2.19条的规定,需保持相对负压的房间。
4 人员净化用室和物料净化用室的气闸室。
9.2.19 下列医药洁净室(区)应与相邻医药洁净室(区)保持相对负压:
1 生产过程中散发粉尘的医药洁净室(区)。
2 生产过程中使用有机溶媒的医药洁净室(区)。
3 生产过程中产生大量有害物质、热湿气体和异味的医药洁净室(区)。
4 青霉素等特殊药品的精制、干燥、包装室及其制剂产品的分装室。
5 病原体操作区。
6 放射性药品生产区。
9.2.20 质量控制实验室净化空调系统的设置,应符合下列要求:
1 实验室净化空调系统应与药品生产区分开。
2 无菌检查室、微生物限度检查实验室、抗生素微生物检定室和放射性同位素检定室的空气洁净度等级,应符合本规范第5.1.13条的规定。
3 阳性对照室和放射性同位素检定室等实验室不应利用回风,室内空气应经过滤后直接排至室外。
9.2.21 中药生产中要求“按医药洁净室(区)管理”的工序,其空气调节和通风,应符合下列规定:
1 应采取通风措施或设置空气调节系统。
2 进入生产区域的空气应经过粗效、中效空气过滤器两级过滤,室内应保持微正压。
3 生产过程中散发粉尘、有害物的房间应设置除尘或排风系统。
9.2.22 局部空气洁净度100级的单向流装置的设置,应符合下列要求;
1 应覆盖暴露非最终灭菌无菌药品、包装容器及传送设施的全部区域。
2 当单向流装置面积较大,且采用室内循环风运行时,应采取减少空气洁净度100级区域与室内周围环境温差的措施,空气洁净度100级区城内的温度不应大于室内设计温度2℃,并不应高于24℃。
3 空气洁净度100级的单向流装置,应采用侧墙下部或地面格栅回风。
4 局部空气洁净度100级的单向流装置外缘宜设置围帘,围帘高度宜低于操作面。
5 单向流装置的设置应便于安装、维修及更换空气过滤器。
9.2.23 净化空气调节系统的空气处理机组的设计和选用,应符合下列要求:
1 空气处理机组应有良好的气密性,箱内静压为1000Pa时,漏风率不得大于1%。
2 空气处理机组内表面应光滑、耐腐蚀和易于清洁。
3 空气处理机组应有良好的绝热性能,外表面不得结露。
4 空气处理机组的送风机应按净化空气调节系统的总风量和总阻力选择,各级空气过滤器的阻力应按其初阻力的1.5~2.0倍计算。
5 空气处理机组的整体结构应有足够的强度,在运输、安装及运行时不得出现机组外壳变形。
9.3 气流流型和送风量
9.3.1 气流流型的设计应符合下列要求:
1 气流流型应满足空气洁净度等级的要求,空气洁净度100级时,气流应采用单向流流型。
2 空气洁净度10 000级、100 000级和300 000级时,气流应采用非单向流流型。非单向流气流流型应减少涡流区。
3 医药洁净室(区)气流分布应均匀。气流流速应满足生产工艺、空气洁净度等级和人体卫生的要求。
9.3.2 医药洁净室(区)气流的送、回风方式应符合下列要求:
1 医药洁净室(区)气流的送、回风方式应符合表9.3.2的规定。
2 散发粉尘或有害物质的医药洁净室(区),不应采用走廊回风,且不宜采用顶部回风。
9.3.3 医药洁净室(区)内各种设施的布置,应满足气流流型和空气洁净度等级的要求,并应符合下列规定:
1 单向流医药洁净室(区)内不宜布置洁净工作台;在非单向流医药洁净室(区)内设置单向流洁净工作台时,其位置宜远离回风口。
2 易产生污染的工艺设备附近应设置排风口。
3 有局部排风装置或需排风的工艺设备,宜布置在医药洁净室(区)下风侧。
4 有发热量大的设备时,应有减少热气流对气流分布影响的措施。
5 余压阀宜设置在洁净空气流的下风侧。
9.3.4 医药洁净室(区)的送风量,应取下列最大值:
1 按表9.3.4中有关数据计算或按室内发尘量计算。
2 根据热、湿负荷计算确定的送风量。
3 向医药洁净室(区)内供给的新鲜空气量。
9.4 风管和附件
9.4.1 风管断面尺寸应满足对内壁清洁处理的要求,宜设置清扫口。风管应采用不易脱落颗粒物质、不易锈蚀,且耐消毒的材料。
9.4.2 净化空气调节系统应按需要设置电动密闭阀、风量调节阀、防火阀、止回阀等附件,各医药洁净室(区)的送、回风管段,应设置风量调节阀。
9.4.3 下列情况的通风、净化空气调节系统的风管,应设置防火阀:
1 风管穿越防火区的隔墙处,穿越变形缝的防火隔墙的两侧。
2 净化空调系统总风管穿越通风、空气调节机房的隔墙和楼板处。
3 垂直风管与每层水平风管交接的水平管段上。
4 水平风管与垂直风管处于不同的防火分区时,水平风管与垂直风管的交接处。
9.4.4 风管穿越使用易燃、易爆介质生产区的隔墙或防爆隔墙时,应设置防火阀和止回阀。
9.4.5 医药洁净室(区)净化空气调节系统的风管和调节阀,以及高效空气过滤器的保护网、孔板和扩散孔板等附件的制作材料和涂料,应根据输送空气洁净度等级及所处空气环境条件确定。
9.4.6 医药洁净室(区)内排风系统的风管、调节阀和止回阀等附件的制作材料和涂料,应根据排除气体的性质及所处空气环境条件确定。
9.4.7 用于无菌洁净室(区)的送风管、排风管、风阀及风口的制作材料和涂料,应耐受消毒剂的腐蚀。
9.4.8 在空气过滤器前后,应设置测压孔或压差计。各系统风口的高效及亚高效空气过滤器设置的压差计不宜少于两支。在新风管以及送风、回风和排风总管上,应设置风量测定孔。
9.4.9 风管、附件及辅助材料的选择,应符合现行国家标准《洁净厂房设计规范》GB 50073的有关规定。
9.5 监测与控制
9.5.1 医药工业洁净厂房应设置净化空气凋节系统自动监测与控制装置。装置应具有参数检测、参数自动调节与控制、工况自动转换、设备状态显示、连锁与保护等功能。
9.5.2 在净化空气调节系统运行中,应对医药洁净室(区)的空气洁净度、温湿度、有检测要求的室内压差、净化空调机组等静态、动态运行及有关参数进行实时显示和记录,并应对送风风量等关键参数予以超限报警。
9.5.3 净化空气调节系统的风机宜采用变频控制。总风管上宜设置风量传感器及显示器。
9.5.4 净化空气调节系统的电加热及电加湿应与送风机连锁,并应设置无风和超温断电保护。采用电加湿时应设置无水保护。加热器的金属风管应接地。
9.5.5 净化空气调节冷热源和空气调节水系统的监测和控制,应符合现行国家标准《采暖通风与空气调节设计规范》GB 50019的有关规定。
9.6 青霉素等药品生产洁净室的特殊要求
9.6.1 下列特殊药品生产的净化空气调节系统应独立设置,其排风口应位于其他药品净化空调系统进风口全年最大频率风向的下风侧,并应高于该建筑物屋面和净化空调系统的进风口:
1 青霉素等高致敏性药品。
2 β-内酰胺结构类药品。
3 避孕药品。
4 激素类药品。
5 抗肿瘤类药品。
6 强毒微生物及芽孢菌制品。
7 放射性药品。
8 有菌(毒)操作区。
9.6.2 青霉素等特殊药品的精制、干燥、包装室及其制剂产品的分装室的室内应保持正压,与相邻房间或区域之间应保持相对负压。
9.6.3 青霉素等特殊药品的生产区,应采取防止空气扩散至其他相邻区域的措施。
9.6.4 青霉素等特殊药品生产区的空气均应经高效空气过滤器过滤后排放。二类危险度以上病原体操作区及生物安全室,应将排风系统的高效空气过滤器安装在医药洁净室(区)内的排风口处。
.
10 给水排水
10.1 一般规定
10.1.1 医药洁净室(区)的给排水干管,应敷设在技术夹层或技术夹道内,也可地下埋设。
10.1.2 医药洁净室(区)内应少敷设管道,与本区域无关管道不宜穿越,引入医药洁净室(区)内的支管宜暗敷。
10.1.3 医药洁净室(区)内的管道外表面应采取防结露措施。防结露外表层应光滑、易于清洗,并不得对医药洁净室(区)造成污染。
10.1.4 给排水支管穿越医药洁净室(区)顶棚、墙壁和楼板处宜设置套管,管道与套道之间应密封,无法设置套管的部位应采取密封措施。
10.2 给 水
10.2.1 医药洁净室(区)应根据生产、生活和消防等各项用水对水质、水温、水压和水量的要求,分别设置直流、循环或重复利用的给水系统。
10.2.2 给水管材的选择,应符合下列要求:
1 生活给水管应选用耐腐蚀、安装连接方便管材,可采用塑料给水管、塑料和金属复合管、铜管、不锈钢管及经防腐处理的钢管。
2 循环冷却水管道宜采用钢管。
3 管道的配件宜采用与管道材料相应的材料。
10.2.3 人员净化用室的盥洗室内宜供应热水。
10.2.4 医药工业洁净厂房周围宜设置洒水设施。
10.3 排 水
10.3.1 医药工业洁净厂房的排水系统,应根据生产排出的废水性质、浓度、水量等确定。有害废水应经废水处理,达到国家排放标准后排出。
10.3.2 医药洁净室(区)内的排水设备以及与重力回水管道相连的设备,必须在其排出口以下部位设置水封装置,水封高度不应小于50mm。排水系统应设置透气装置。
10.3.3 排水立管不应穿过空气洁净度100级、10 000级的医药洁净室(区);排水立管穿越其他医药洁净室(区)时,不应设置检查口。
10.3.4 医药洁净室(区)内地漏的设置,应符合下列要求:
1 空气洁净度100级的医药洁净室(区)内不应设置地漏。
2 空气洁净度10 000级、100 000级的医药洁净室(区)内,应少设置地漏;需设置时,地漏材质应不易腐蚀,内表面应光洁、易于清洗,应有密封盖,并应耐消毒灭菌。
3 空气洁净度100级、10 000级的医药洁净室(区)内不宜设置排水沟。
10.3.5 医药工业洁净厂房内应采用不易积存污物并易于清扫的卫生器具、管材、管架及其附件。
10.3.6 排水管道材料的选择,应符合下列要求:
1 排水管道应选用建筑排水塑料管及管件,也可选用柔性接口机制排水铸铁管及管件。
2 当排水温度大于40℃时,应选用金属排水管或耐热塑料排水管。
10.4 消防设施
10.4.1 医药工业洁净厂房的消防设计应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。
10.4.2 医药工业洁净厂房消防设施的设置,应根据生产的火灾危险性分类、建筑耐火等级、建筑物体积以及生产特点等确定。
10.4.3 医药工业洁净厂房消火栓的设置,应符合下列要求:
1 消火栓宜设置在非洁净区域或空气洁净度等级低的区域。设置在医药洁净区域的消火栓宜嵌入安装。
2 消火栓给水系统的消防用水量不应小于10 l/s,每股水量不应小于5 l/s。
3 消火栓同时使用的水枪数不应少于两支,水枪充实水柱不应小于10m。
4 消火栓的栓口直径应为65mm,配备的水带长度不应大于25m,水枪喷嘴口径不应小于19mm。
10.4.4 医药洁净室(区)及其可通行的技术夹层和技术夹道内,应同时设置灭火设施和消防给水系统。
10.4.5 医药工业洁净厂房配置的灭火器,应满足现行国家标准《建筑灭火器配置规范》GB 50140的有关规定。
10.4.6 放置贵重设备仪器、物料的医药洁净室(区)设置固定灭火设施时,除应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定外,尚应符合下列要求:
1 当设置气体灭火系统时,不应采用卤代烷以及能导致人员窒息的灭火剂。
2 当设置自动喷水灭火系统时,宜采用预作用式自动喷水装置。
10.4.7 消防给水管道材料的选择,应符合下列要求:
1 消火栓系统应采用钢管及相应的管件。
2 自动喷水灭火系统应采用内外热镀锌钢管,也可采用铜管、不锈钢管和相应的管件。
.
11 电 气
11.1 配 电
11.1.1 医药工业洁净厂房的用电负荷等级和供电要求,应根据现行国家标准《供配电系统设计规范》GB 50052和生产工艺确定。净化空气调节系统用电负荷、照明负荷宜由变电所专线供电。
11.1.2 医药工业洁净厂房的电源进线,应设置切断装置。切断装置宜设置在医药洁净区域外便于操作管理的地点。
11.1.3 医药工业洁净厂房的消防用电设备的供配电设计,应符合现行国家标准《建筑没计防火规范》GB 50016的有关规定。
11.1.4 医药洁净室(区)内的配电设备,应选择不易积尘、便于擦拭和外壳不易锈蚀的小型加盖暗装配电箱及插座箱。医药洁净室(区)内不宜设置大型落地安装的配电设备,功率较大的设备宜由配电室直接供电。
11.1.5 医药工业洁净厂房内的配电线路,宜按生产区域设置配电回路。
11.1.6 医药工业洁净厂房通风系统的配电线路,宜根据不同防火分区设置配电回路。
11.1.7 医药洁净室(区)内的电气管线宜敷设在技术夹层或技术夹道内,管材应采用非燃烧体。医药洁净室(区)内连接至设备的电线管线和接地线宜暗敷,电气线路保护管宜采用不锈钢或其他不易锈蚀的材料,接地线宜采用不锈钢材料。
11.1.8 医药洁净室(区)内的电气管线管口,以及安装于墙上的各种电器设备与墙体接缝处均应密封。
11.2 照 明
11.2.1 医药洁净室(区)内的照明光源,宜采用高效荧光灯。生产工艺有特殊要求达不到照明设计的技术经济指标时,也可采用其他光源。
11.2.2 医药洁净室(区)内应选用外部造型简单、不易积尘、便于擦拭、易于消毒灭菌的照明灯具。
11.2.3 医药洁净室(区)内的照明灯具宜吸顶明装,灯具与顶棚接缝处应采取密封措施。需采用嵌入顶棚暗装时,安装缝隙应密封,其灯具结构应便于清扫,以及便于在顶棚下更换灯管及检修。
紫外线消毒灯的控制开关应设置在洁净室(区)外。
11.2.4 医药洁净室(区)应根据实际工作的要求提供照度。照度值应符合本规范第3.2.5条的要求。
11.2.5 医药洁净室(区)主要工作室,一般照明的照度均匀度不应小于0.7。
11.2.6 有爆炸危险的医药洁净室(区),照明灯具的选用和安装,应符合现行国家标准《爆炸和火灾危险环境电力装置设计规范》GB 50058的有关规定。
11.2.7 医药工业洁净厂房内应设置备用照明,并应满足所需场所或部位活动和操作的最低照明。
11.2.8 医药工业洁净厂房内应设置应急照明。在安全出口和疏散通道及转角处设置的疏散标志,应符合现行国家标准《建筑设计防火规范》GB 50016的有关规定。在专用消防口处应设置红色应急照明灯。
11.2.9 医药工业洁净厂房的技术夹层内宜按需要设置检修照明。
11.3 通信
11.3.1 医药工业洁净厂房内应设置与厂房内外联系的通信装置。医药洁净室(区)内宜选用不易积尘、便于擦拭、易于消毒灭菌的洁净电话。
11.3.2 医药工业洁净厂房可根据生产管理和生产工艺的要求,设置闭路电视监视系统。
11.3.3 医药工业洁净厂房的生产区(包括技术夹层)等应设置火灾探测器。医药工业洁净厂房生产区及走廊应设置手动火灾报警按钮。
11.3.4 医药工业洁净厂房应设置消防值班室或控制室。消防值班室或控制室不应设置在医药洁净室(区)内。消防值班室或控制室应设置消防专用电话总机。
11.3.5 医药工业洁净厂房的消防控制设备及线路连接、控制设备的控制及显示功能,应符合现行国家标准《建筑设计防火规范》GB 50016、《火灾自动报警系统设计规范》GB 50116和《火灾自动报警系统施工及验收规范》GB 50166等的有关规定。医药洁净室(区)内火灾报警应进行核实。
11.3.6 医药工业洁净厂房中易燃、易爆气体的储存、使用场所、管道入口室及管道阀门等易泄漏的地方,应设置可燃气体探测器。有毒气体的储存和使用场所应设置气体检测器。报警信号应联动启动或手动启动相应的事故排风机,并应将报警信号送至控制室。
11.4 静电防护及接地
11.4.1 医药工业洁净厂房应根据工艺生产要求采取静电防护措施。
11.4.2 医药洁净室(区)内的防静电地面,其性能应符合下列要求:
1 地面的面层应具有导电性能,并应保持长时间性能稳定。
2 地面的表层应采用静电耗散性的材料,其表面电阻率应为1.0×105 ~1.0×1012Ω·cm或体积电阻率为1.0×104 ~1.0×1011Ω·cm。
3 地面应采取导电泄放措施和接地构造,其对地泄放电阻值1.0×105 ~1.0×109Ω。
11.4.3 医药洁净室(区)的净化空气调节系统,应采取防静电接地措施。
11.4.4 医药洁净室(区)产生静电危害的设备、流动液体、气体或粉体管道应采取防静电接地措施,其中有爆炸和火灾危险的设备和管道应符合现行国家标准《爆炸和火灾危险环境装置设计规范》GB 50058的有关规定。
11.4.5 医药工业洁净厂房内不同功能的接地系统的设计应符合等电位连接的要求。
11.4.6 接地系统宜采用综合接地方式,接地电阻值应小于或等于1Ω;选择分散接地方式时,各种功能接地系统的接地体与防雷接地系统的接地体之间的距离应大于20m。医药工业洁净厂房的防雷接地系统设计应符合现行国家标准《建筑物防雷设计规范》GB 50057的有关规定。
附录A 药品生产环境的空气洁净度等级举例
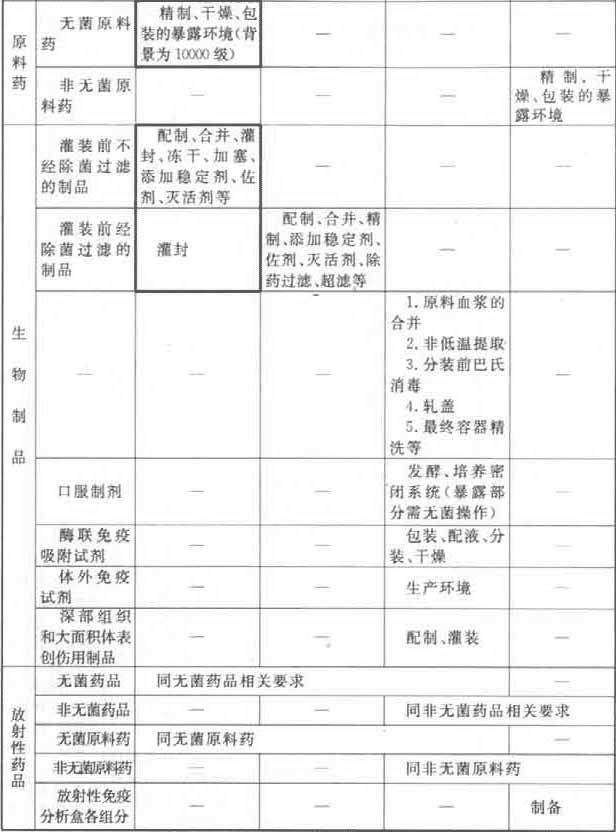
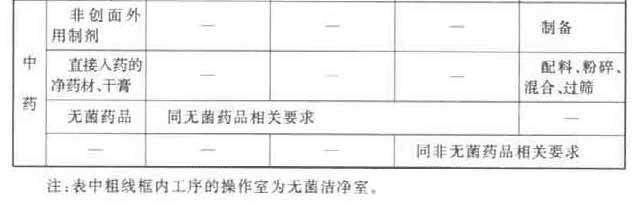
附录B 医药洁净室(区)的维护管理
B.0.1 医药洁净室(区)的使用,应符合下列规定:
1 人员应按本规范第5.2.4条的净化程序出入医药洁净室(区),限制非本洁净室(区)人员进入医药洁净室(区)。
2 物料、工器具、设备等进入医药洁净室(区)前必须净化,进入无菌洁净室(区)前还须消毒灭菌。物料、工器具、设备等净化和消毒灭菌后,应经传递窗或气闸室进入医药洁净室(区)。
3 空气洁净度100级、10 000级的净化空气调节系统宜连续运行。非连续运行的医药洁净室(区),在非生产班次时,净化空气调节系统应有保持室内正压、防止室内结露的措施。
4 当医药洁净室(区)采用高度真空吸尘器进行清扫时,必须定期检查吸尘器排气口的含尘浓度。
B.0.2 医药洁净室(区)的空气监测,应符合下列要求:
1 应对医药洁净室(区)空气定期监测。监测项目和频次应符合表B.0.2的规定。特殊要求的医药洁净室(区)另行规定。
2 下列情况应更换高效过滤器:
1)气流速度降低,即使更换初效、中效空气过滤器后,气流速度仍不能增大时。
2)高效空气过滤器的阻力达到初阻力的1.5~2倍时。
3)高效空气过滤器出现无法修补的渗漏时。
B.0.3 医药洁净室(区)的维护,应符合下列要求:
1 医药洁净室(区)的维护管理,应包括对净化空气调节系统、生产设备、设施和操作人员的管理;应建立相应的管理制度和记录。
2 使用具有腐蚀、易燃、易爆等有毒有害物品的医药洁净室(区),应有相应的安全措施。
3 应建立医药洁净室(区)计划检修制度,对净化空气调节系统实行定期检修、保养制度。检修、保养记录应存档。
附录C 医药洁净室(区)的验证
C.0.1 医药洁净室(区)的验证,应包括下列内容:
1 医药洁净室(区)的验证,应包括室内系统及设施,如净化空气、工艺用水等系统及设施的安装确认、运行确认和性能确认。
2 系统及设施的安装确认,应包括各分部工程的外观检查和单机试运转。
3 系统及设施的运行确认,应在安装确认合格后进行。内容应包括带冷(热)源的系统联合试运转,并不应少于8h。
4 医药洁净室(区)的综合性能确认,应包括表C.0.1项目的检测和评价。
C.0.2 医药洁净室(区)的验证,应符合下列规定:
1 国家现行标准《洁净室施工及验收规范》JGJ 71。
2 现行国家标准《医药工业洁净室(区)悬浮粒子的测试方法》GB/T 16292。
3 现行国家标准《医药工业洁净室(区)浮悬菌的测试方法》GB/T 16293。
4 现行国家标准《医药工业洁净室(区)沉降菌的测试方法》GB/T 16294。
5 国家现行《药品生产质量管理规范》。
6 现行《中华人民共和国药典》。
C.0.3 医药洁净室(区)的验证,应包括下列文件:
1 医药洁净室(区)主要设计文件和竣工图。
2 主要设备的出厂合格证书、检验文件。
3 设备开箱检查记录、管道压力试验记录、管道系统吹洗脱脂记录、风管漏风记录、竣工验收记录。
4 单机试运转、系统联合试运转和医药洁净室(区)性能测试记录。
本规范用词说明
1 为便于在执行本规范条文时区别对待,对要求严格程度不同的用词说明如下:
1)表示很严格,非这样做不可的用词:
正面词采用“必须”,反面词采用“严禁”。
2)表示严格,在正常情况下均应这样做的用词:
正面词采用“应”,反面词采用“不应”或“不得”。
3)表示允许稍有选择,在条件许可时首先应这样做的用词:
正面词采用“宜”,反面词采用“不宜”;
表示有选样,在一定条件下可以这样做的用词,采用“可”。
2 本规范中指明应按其他有关标准、规范执行的写法为“应符合……的规定”或“应按……执行”。
